2月18日晚间,真实生物科技有限公司(以下简称真实生物)递表港交所主板,中金公司为其独家保荐人。这是继2022年8月4日之后,真实生物第二次申请在港交所上市。
根据弗若斯特沙利文的资料,由真实生物研发生产的阿兹夫定,具有广谱抗病毒活性,是全球唯一一款用于治疗HIV的双靶点口服核苷药物,目前已经覆盖了全国31个省市区超过50000家医疗终端。

时隔两年多
真实生物二度赴港IPO
2月18日晚,港交所公布真实生物IPO招股书,这家位于河南省平顶山市的生物科技企业再度开启赴港IPO。记者注意到,这是真实生物继2022年8月4日之后,第二次申请在港交所上市。
成立于2012年的真实生物,是一家以创新药物研发为核心的民营企业,专注于治疗病毒感染、肿瘤及心脑血管疾病的创新药物的开发、制造和商业化。
2023年、2024年,真实生物收入分别约为3.44亿元和2.38亿元,亏损及全面亏损总额分别为7.84亿元和4004.2万元,亏损额大幅收窄。
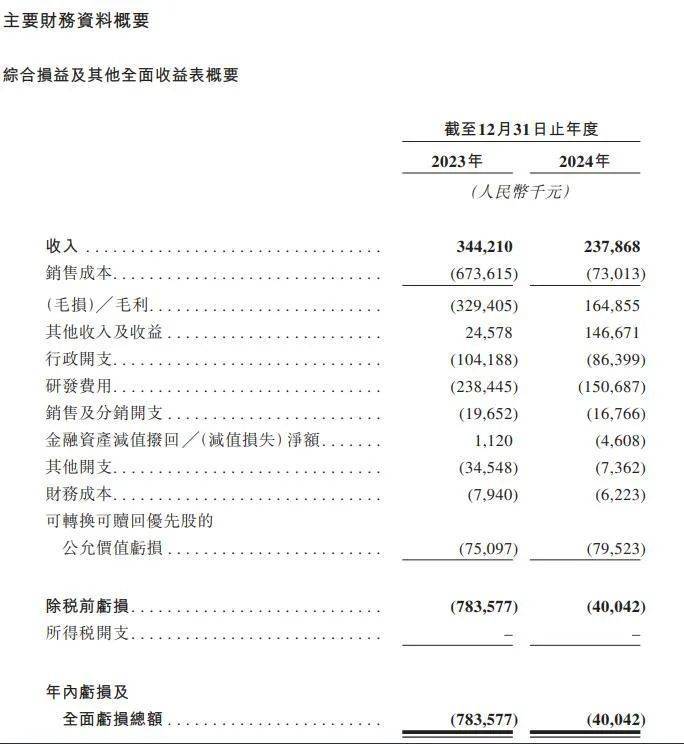
产品销售方面,根据其招股书,2023年,真实生物仅有一名主要客户——复星医药产业,销售额为3.44亿元,占总收入的100%。2024年,尽管前五大客户占总收入的99.6%,但复星医药仍为主要客户,销售额为2.36亿元,占总收入的99.2%;其他四家大客户贡献的收入仅为100万元,占总收入的0.4%。
2024年9月,真实生物与复星医药产业终止合作,并开始与53家经销商合作,预计2025年的收入将主要来自这些经销商。
真实生物的核心产品阿兹夫定作为1.1类原创新药,2021年7月获得国家药监局用于治疗HIV感染附条件批准上市,并于2022年7月获得国家药监局用于治疗COVID-19附条件批准上市,成为首款中国公司研发的获国家药监局批准用于治疗COVID-19的口服抗病毒药物。
据了解,阿兹夫定已于2023年正式纳入国家基本医疗保险药品目录(NRDL),并在2024年成功完成了NRDL续约。目前,该产品已经覆盖了全国31个省市区超过50000家医疗终端。

对于融资用途,真实生物在招股书里表示,将主要用于核心产品阿兹夫定治疗HIV感染及血液肿瘤及实体肿瘤的研发及商业化;阿兹夫定连同公司其他候选产品联合疗法的研发,用于治疗HIV感染及若干肿瘤适应症;其他候选药物的研发;进一步建设研发平台;用作营运资金及其他一般企业用途等。
去年研发投入1.51亿元
研发团队、创新平台等多重优势驱动医药创新
时隔两年多,真实生物二度冲击港交所,有哪些新亮点?
核心产品阿兹夫定方面,据了解,真实生物阿兹夫定生产基地年产能约30亿片,产品不仅能够抑制病毒的复制,还能通过增强免疫功能达到标本兼治的效果,目前已累计销售超过1000万瓶。
研发费用方面,作为一家创新药研发公司,真实生物每年投入大量资金用于研发投入,2023年、2024年研发费用分别为2.38亿元、1.51亿元。
研发团队方面,记者在采访中了解到,真实生物目前拥有一支由国际药物研发领域资深专家组成的内部研发管理团队。公司董事长、执行董事、首席执行官兼首席科学官杜锦发博士是曾获得盖伦奖的丙肝治疗药物索非布韦的发明者之一。该药物被《细胞》杂志誉为当代最重大的公共卫生成就之一。多位高级管理层人员在创新药物研发、转化医学及临床试验管理等领域拥有平均近30年的丰富经验。
记者在采访中了解到,真实生物建立了综合全面的研发平台,包括高选择性新型核苷类广谱抗肿瘤药物研发平台、TOPO1抑制剂及XDC药物研发平台、药物靶点发现及验证平台和创新药物设计及优化平台。
真实生物表示,这些平台涵盖了整个药物开发过程,从早期靶点筛选到临床前研究,再到临床试验及后续优化,为加速创新药物的发现与开发提供了强有力的技术支撑和系统性保障。
继续聚焦原研药研发
多个研发项目正在进行中
谈起企业的下一步发展,真实生物董事长杜锦发在接受记者采访时表示,2025年,公司将继续聚焦原研药研发,推动药物源头创新,提高临床开发能力和效率,更高效地推进创新药物的临床研究和注册。目前,多个研发项目正在进行中。
2024年9月,阿兹夫定用于治疗晚期实体瘤患者的临床试验,获得国家药监局IND批准,并于2025年1月在上海启动I期临床试验。这一成果不仅为药物进入临床试验提供了有力依据,还可能为肿瘤治疗带来重大突破。
在抗病毒领域,真实生物新一代口服长效HIV候选药物CL-197,正处在I期临床阶段,该药有望成为全球首款全口服、长效艾滋病治疗药。
此外,具有全球知识产权的新型TOPO1抑制剂在对伊立替康耐药的人体类器官试验中,该候选药物显示出显著的抑制肿瘤效果,对伊立替康耐药的肿瘤细胞的抑制活性是伊立替康的400倍,为应对多种肿瘤的耐药性提供了有效的解决方案。目前,上海研发团队正加速推进临床前流程,争取进入到IND阶段。
阿兹夫定与哆希替尼合并治疗非小细胞肺癌,产生显著的协同作用,IIT试验和临床前研究数据良好,有望2025年上半年拿到临床试验许可批准。
真实生物还有一款在研的ADC药物,其针对前列腺特异性膜抗原(PSMA)的新型单克隆抗体具有全新设计结构,可有效裂解的亲水性连接子及细胞毒性有效载荷。临床前研究中显示,该候选药物的肿瘤生长抑制率高达95%,展现良好肿瘤生长抑制效用的同时具有良好的安全性。
“我们计划开发其在多种肿瘤适应症上的应用,包括前列腺癌、膀胱癌、肾癌。目前深圳研发团队正加速推进临床前研究,争取早日完成IND申报。”杜锦发说。
责编:刘安琪 | 审校:张翼鹏 | 审核:李震 | 监审:万军伟







 京公网安备 11011402013531号
京公网安备 11011402013531号