
本文特别鸣谢以下受访者:
陈侃博士 启明创投合伙人、医疗健康行业共同负责人
宋高广博士 北极光创投 合伙人
洪镭博士 光源资本董事总经理、医疗负责人
李寅博士 元禾辰坤 投资总监
张元博士 元禾辰坤金谷资本董事总经理
邵辉博士 湖岸生物副董事长,首席商务官
五十年与十年若去查各国的药品管理办法,关于创新药的定义,洋洋洒洒写上万字论文都不为过。然而,在资本眼中,创新药的定义只浓缩为几个标签:高昂的研发费用,漫长的临床周期,严格的专利保护和巨额的商业回报。
在业内,大家的共识是中国创新药行业始于2015年,至于那一年发生了什么,我们稍后详解。
回顾美国创新药的发展,在Biotech出现之前,医药领域的 VC 机构并不多。VC 机构真正进入创新医药领域的标志,是1976年基因泰克(美国基因工程技术公司)的成立,该公司由风险投资家Robert A. Swanson和生物化学家Herbert Boyer博士共同创办。从这个时间点来看,明年(2025年)恰好是中国创新药十年、美国创新药五十年。
我们会发现一个规律,宋高广博士:“美国那些老牌的创新药公司从创立到真正实现盈利,大概都经历了十年及以上的发展历程。”
1976 年成立的基因泰克,虽然1980年10月就在纳斯达克上市了,但它真正实现盈利的时间,或者说它核心产品爆发的时间则是在1997年。
另一家同样以风险投资作为启动资金的老牌创新药公司安进Amgen,于1981年创立,在一度经历了贱卖自己当家EPO给强生集团以求生存的囧境之后,于1992年首次跻身财富500强,当年公司产品销售首次突破10亿美元。
其实美国的创新药行业也经历过多次起伏,也经历过几次的生物科技股泡沫的倾覆,宋高广博士:“比如1991年医疗股泡沫的破裂。以至于当时生物医药,生物科技的投资一度陷入冰点。
美国生物科技公司所面临的周期性影响,一直在于工程性风险(研发是否能把产品做出来)和销售性风险(销售能否高价把产品卖出去)。几乎没有所谓的政策性风险,唯一称得上政策性风险的变动,也只是在调整专利保护的大小范围。
回看美国五十年的生物科技的发展,从结果来说确实经历了很多的起起伏伏,但从影响因素来看,却与中国大相径庭。
2015年之前:下海、疯狂与急冻
和众多其他行业的民营企业崛起的契机相似,受益于改革开放和国企改制带来的积极影响,很多国内的医药公司都集中成立于1995—2000年左右。例如1997年完成私有化的恒瑞医药,1998年成立的昭衍新药,2002年成立舒泰神。这一部分医药企业,成为了中国生物医药产业发展的基石。
1998年,国家医药管理局合并了卫生部的药政局,把原来国家医药管理局的生产、流通的监督管理职能,以及卫生部药政、药检职能合并,组建国家药品监督管理局(SDA),成为国务院直属部门。2003年,在国家药品监督管理局(SDA)基础上组建(SFDA)。
“在 1998 年之前,因为我们一直处于‘缺医少药’的状态。”宋高广博士:“所以 1998 年到 2007 年之间批准了大量的新药。近10年间获批的新药多达2万多种。然而这种大规模的放开审批,必然引发了大量的造假、劣质药、无效药的问题。当时的国家食品药品监督管理局局长郑筱萸也因此身陷囹圄。”
“自此以后,在新药审批这个环节上,中国几乎陷入停滞状态。从2007年到2015年的8年时间里,我国仅批准了30多个创新药,而同期美国每年批准的创新药就约35个,也就是说这段时间里,我们八年的新药审批进度还不及美国一年。”
虽然审批环节极度收紧,但是在另一个外溢环节却非常活跃,就是销售环节。取代传统国外大药企所采用的”学术营销“模式,一种新的营销模式—“带金销售”悄然出现,并迅速成为国内药企的主流销售模式。不可否认的是,这种销售模式在当时非常有效,很大程度上解决了积压的上万种新药的销售问题,也让医药行业进入了”销售为王”的时代。再加上2019年创业板的开市,众多创新药企们纷纷挂牌上市,生物医药领域一时间成就了一片热闹景象。
“直到2015年之前,这部分积压的新药和药企才逐渐被市场消化完毕。”
2015-2021年:新生、泡沫与退潮
2015年被行业内普遍定义为中国创新药元年。因为在这一年,SFDA重启了对新药的审评。
而面对近8年来2万多件新药审评的积压,处理预期需要十年。新任SFDA局长毕井泉,采取雷霆手段发动7.22 临床数据自查核查。“你们这两万多件新药不是都做了学术营销,自己觉得数据也都挺好吗?现在展开自查,如果你觉得自己的数据没问题,你就留下,如果觉得数据有问题,就自己撤回。如果你留下了,但是被我查出有问题,那就会有非常严重的处罚等着你。”
结果一夜之间85%的申请主动撤回,后面又陆续撤回了90%。“这个事件标志着中国创新药领域开始了对数据的严格审查,也标志着中国创新药产业进入了一个新的周期。”
2015-2021年叠加了一系列的利好因素:医药政策的改革(《国务院关于改革药品医疗器械审评审批制度的意见》),与国际药物研发的接轨(中国加入了ICH),海外人才的回归,区域政策的扶持(苏州工业园区和张江工业园区等),资本退出路径的顺畅(港股18A政策和2019年科创板),再加上8年的审评空档期给市场留出的巨大的fast-follow的空间,在上述所有要素的综合作用下,大量的创新药企业开始蓬勃发展。
同一时期,那些敢为天下先的投资机构,像礼来、龙磐这类基金,在这个阶段取得了令人羡慕的投资回报。再加上互联网和消费行业的红利出尽,硬科技逐渐成为风险投资青睐的方向,一时间众多投资机构都建立起自己的Biotech团队,投身于创新药这个充满风险和诱惑的产业。
中国创新药的黄金时代正式开幕,而黄金时代本身就意味着泡沫。
2010年成立的百济神州,在2015年至2021年间进行了多轮高额融资,估值从几亿美元迅速增长至数百亿美元,在上市初期仍处于亏损状态,且主要收入来自合作伙伴的里程碑付款。
另一个例子是2011年成立的信达生物,同样在2015年至2018年间进行了多轮融资,估值从几亿美元迅速攀升至数十亿美元。2018年在港交所上市时,信达生物的市盈率高达数百倍,远高于行业平均水平。
与上述两家公司类似,君实生物、康希诺生物、复宏汉霖等一众公司在这一时期都经历不同程度的快速融资,估值疯涨和上市之后的大幅回落调整。
“这个泡沫的产生,一个是科创板的开放和港股18 A的刺激,加上2020-2021年间的疫情,使得大家对医疗行业的重视程度迅速提升,再加上资本市场的烘托,三者的叠加,最终催生了中国医药产业这样一个巨大的泡沫。从 2021年的9月开始下行,一直到现在,持续了三年的时间。行业里的所有人也一直在消化这个巨大泡沫带来的后果。”
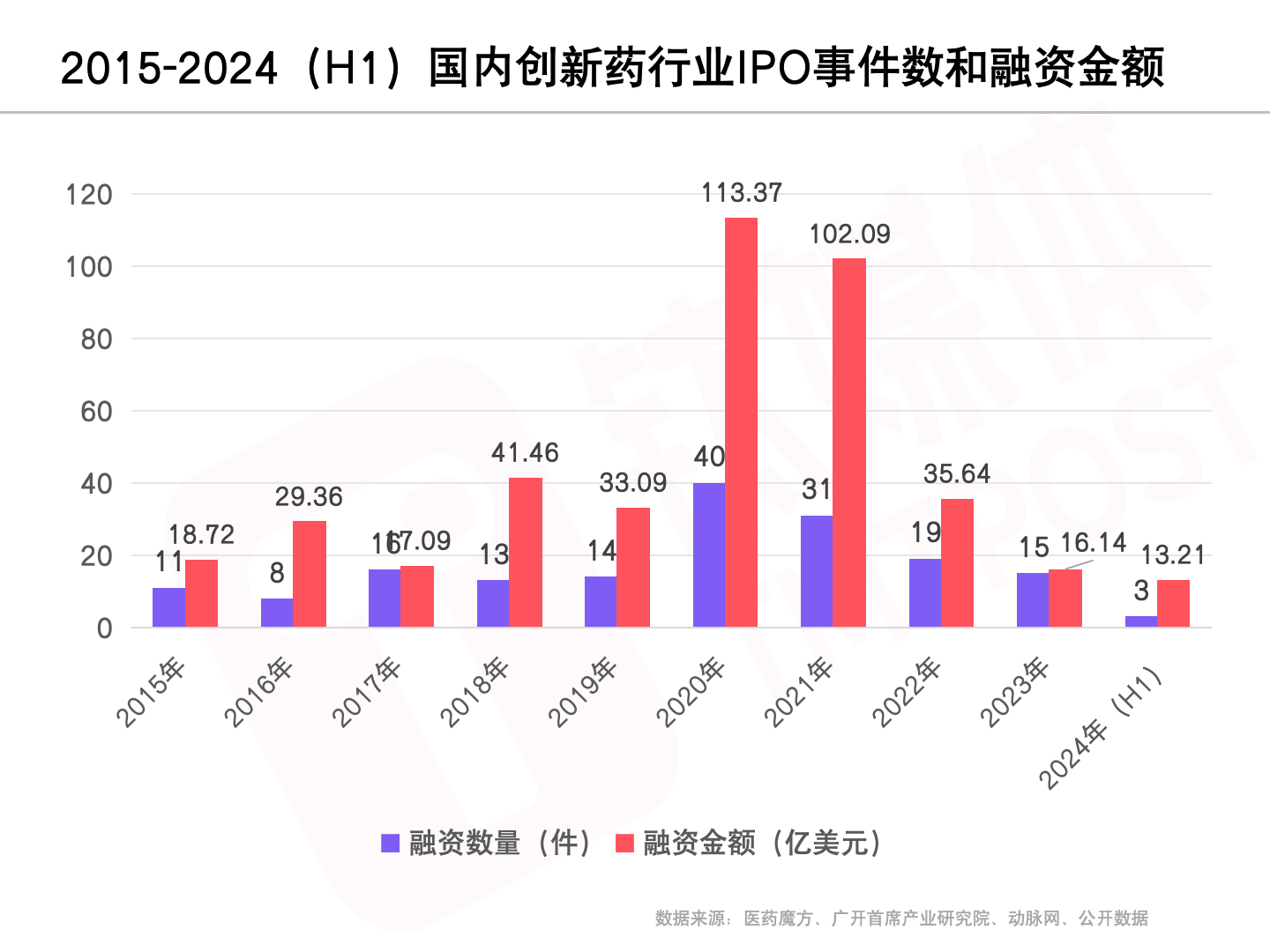
研发
启明创投合伙人、医疗健康行业共同负责人陈侃博士认为中国创新药研发经历了从爬到走到跑的过程,如今接近领头羊的状态。
领头羊的位置何解?截至2024年8月,中国新药上市的数量来到910,这一数字接近了美国的一半,在国际上位列第二,位居第三的日本的新药上市数量则为797。
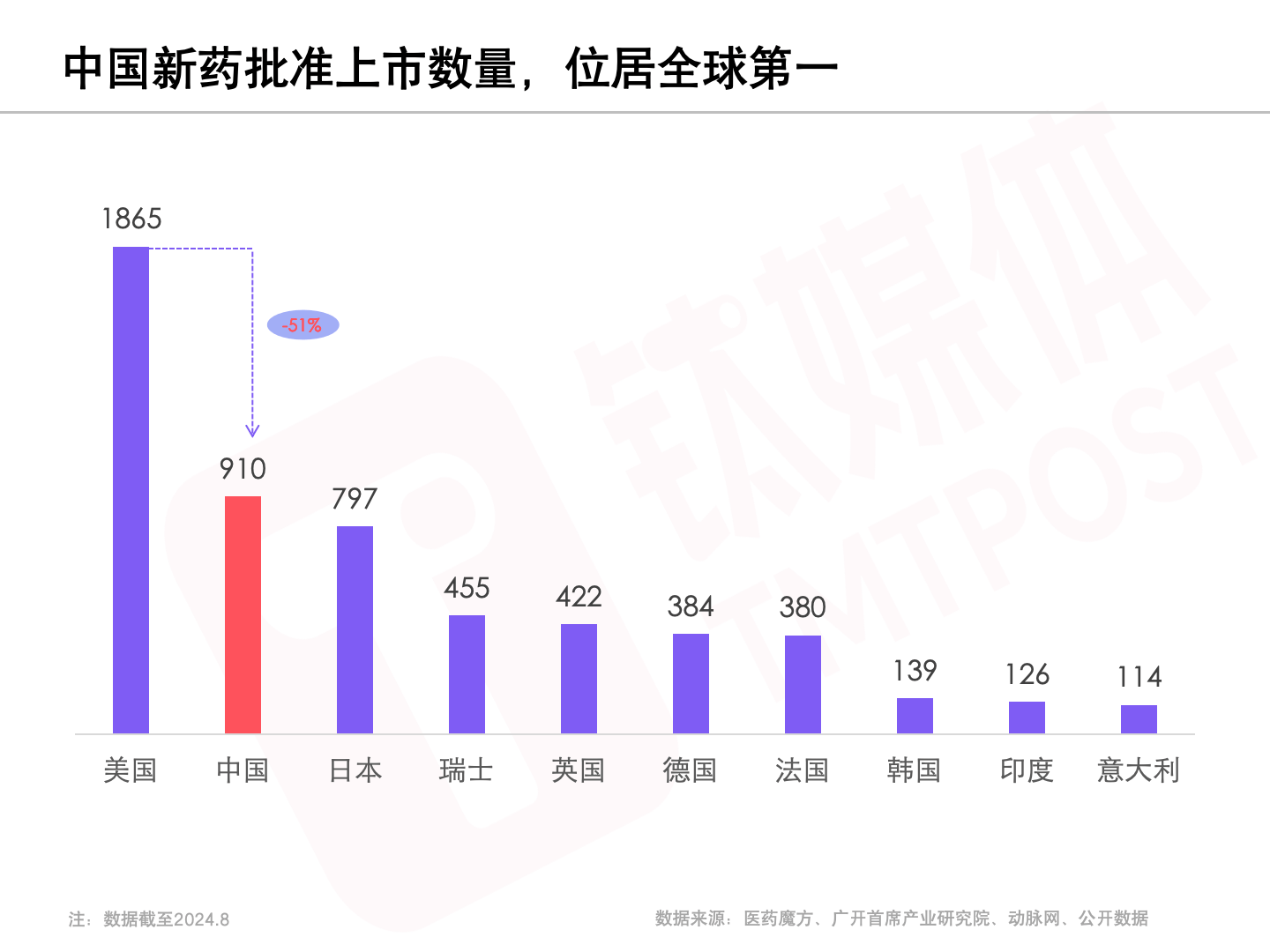
获批上市的新药代表现在,而在研的新药管线代表未来。据医药魔方数据库统计,截至今年8月,中国在研新药管线数量高达5380,在全球占比超过三分之一。与第一的美国(5397)相比,差距已经微乎其微。而排在第三位的韩国,在研管线数量就大幅降到了738。所有新药管线中代表最高创新纯度的First in class管线,中国也同样取得了全球第二的亮眼成绩。
数量上的优势似乎还不能完全说明问题,洪镭博士又为我们提供了另一组数据:
近两年,本土创新药领域逐渐涌现出一批年销售额超过10亿元的大单品,如百济神州的小分子化药泽布替尼、复宏汉霖的曲妥珠单抗。我国正在逐渐完成由Me-too向Best-in-class和First-in-class进阶的产业升级。创新药产品质量也在初步得到全球市场验证,2023年、2024年出现了一批重磅的BD,如百利天恒(首付款8亿美元)、同润(首付款7亿美元)、锐格医药(首付款8.5亿美元)等;此外普方、亘喜等企业分别以约18亿美元、12亿美元被MNC收购也标志着国际产业方对中国标的的全面认可。
究其原因,李寅博士向我们表达道:“经过国内创新药企业这么多年从跟随式创新到原创式创新的发展,一方面已经形成了非常高的“工程师红利”,积累了大量的经验丰富的一线研发人才。直接促使我们在进行fast-follow的过程中速度更快、分子优化更好、工程创新更好、稳定性更好或者成本更低。另一方面,国内的产业链完善程度也已经非常之高,以药明为代表的一批CRO公司,无论是提供设备、耗材,还是提供一些软性服务,都极具全球竞争力。”
面对目前我国生物医药领域的基础科研能力,临床转化能力以及产业化能力都在不断升级的大背景下。陈侃博士表示:“需要认知到的是,创新药第一波“低垂的果实”已经被摘完了,更长的时间周期内,中国更创新的技术比如first-in-class的靶点或许是下一步的机会,这些依靠中国临床资源开发的新靶点将来能够在全世界产生足够大的影响力。”
专利
知识产权是所有创新药的生命线。
“所有创新药的核心就是它的化学结构,而这种结构在技术上是可以被‘修饰’的。”宋高广博士表示:“经过‘修饰’之后的药物,只要不影响整体结构的有效性和安全性,就可以成为我们常说的仿制药。专利保护的核心就是保护这些修饰点不被竞争对手模仿。如果没有专利保护的话,药企就与一个化工企业无异。而一个化工生产型企业的利润,是不可能支撑创新药研发所需要的巨额成本的。”
“专利悬崖”是制药行业的独特现象,指的是在药物专利保护期内,可以给企业带来丰厚的利润。而在保护期过后,由于仿制药的大量出现,带来的利润也会随之一落千丈。
现实情况是美国对于专利保护的申请比较宽松,申请10个修饰点,就能保护10个修饰点,进而对于专利的保护就比较充分。而国内目前对于专利保护的申请较为严格,申请10个修饰点,往往只能保护3个,其结果就是对于专利的保护不够充分,剩下的7个修饰点都可以用来绕过专利。
这种不充分的专利保护的直接结果,就是某一款原研药可能刚刚上市,一两年内市场上就会迅速出现4-5家相同疗效的仿制药,而且价格还会低得惊人。无奈之下,原研药企业被迫进入低价竞争的内卷之中,最终呈现出和境外市场相比落差巨大的产品定价差异。
以首款在美上市的国产PD-1抗癌药为例。2023年10月,君实生物宣布其特瑞普利单抗获FDA批准,成为在美国上市的首个中国自主研发和生产的创新生物药。这款用于复发/转移性鼻咽癌的治疗药物,在中国的售价,大概只有美国售价的3%。对此张元博士表示:“我个人投国内的创新药,基本不会把专利列为首要考虑因素。”
值得思考的问题是:如果我们的专利保护体系现在就100%对标美国,设立非常高的保护壁垒,会出现什么结果?
“一方面,大量以仿制药为主要产品管线的本土企业将会被挤压,甚至可能消亡。另一方面,老百姓的用药成本会变高。”
医保
短视频平台中,历年国谈的“灵魂砍价”环节往往让人大呼过瘾,但对创新药企业来说却并不是那么“愉快”的回忆。
医保基金一直是国内药品市场的最大支付方,错过国谈基本就等于错过了国内市场最大的蛋糕。因此,“以价换量”就成了符合要求的创新药企业蜂拥而至的底层逻辑。
2019年以来,通过医保谈判进入目录的新药数量明显上升,尤其是国产创新药。据不完全统计,截至2023年,进入医保的国产新药数量从2019年的9款增至104款,占已上市国产新药的比例从13.2%提升至50.7%。
首次入选的创新药品,平均价格降幅大约在40%至62%之间,绝大多数创新药进入医保之后,都实现了“以价换量”,销售额大幅增长。以国产PD-1抗肿瘤药物信迪利单抗为例,其于2019年被纳入医保,2020年销售额即实现了954%的增长,达到2.73亿元。即便如此,大量的创新药企们依然还在持续地亏损中,以价换来定“量”并没有改变创新药企们的经营困境。
“问题还是在于知识产权。”宋高广博士认为:“由于专利保护力度不够,新药第一年进入医保后,第二年就会有很多的竞争对手涌入。一旦集采出现内卷,最终大家都没法盈利。”
但是这种国家主导的医保谈判,把一个药品控制在很低的价格,不是中国特有的。张元博士也提到:“世界上绝大多数国家包括发达国家其实是采用的也是同样的模式。最大的问题其实还是同质化。我们可以看到很多独家性质的药品,即使医保谈判,也没有办法集采,也就没有办法把价格压得很低。”
提到对医保制度的建议,洪镭博士也表示:尽管医保覆盖面和支付比例有所提高,定价限制依然阻碍了初创企业的资本回笼。我们期待未来的医保政策能够给予创新药更多的支持和包容。
正如中国医药创新促进会执行会长宋瑞霖先生所言:“中国创新药不是要求医保‘包养’,而是‘包容’,更要‘松绑’,让它们有机会展现市场竞争力。”
今年2月,国家医保局下发《关于建立新上市化学药品首发价格形成机制鼓励高质量创新的通知》征求意见稿,提出用一种新的“分层定价机制”来拉高真正具有创新价值的药品市场定价,同时刚刚结束的2024年医保谈判也进一步强调了“鼓励创新药以合理的价格纳入医保”。可见,在“普惠”和“保护创新”之间,医保局也一直在努力寻找一个平衡。
资本
由于难以自我造血,创新药企业对于融资的依赖度之高,由来已久。
2015-2021年期间,受益于港股18A和科创板的开放,市场化资金的加速流入曾一度成为支撑创新药企业发展的主要动能。“但自2023年以来,由于IPO步伐放缓、资本对于企业退出途径的担忧、企业后续一轮融资困难导致的持续经营风险,以及基金募集难度的增大,创新药领域投资遇冷。”洪镭博士表示:“另一方面,国内投资生物医疗的资金属性也发生了根本性的变化。”

在过去,美元以及市场化资金是投资创新药的主力军。其中的成长期创新药更是当时美元基金的主要投向之一。而现在,美元投资人的缺位确实给创新药企业的融资带来了不小的挑战。
“投资人退出渠道非常有限”,邵辉博士表示:“企业虽然在港股和美股可以IPO,但是融资额非常有限,解禁后股价马上出现断崖式下跌,流动性也很差,投资人靠在二级市场出售大量股票很困难。”
“从资金端来看,15年到21年是经历了一个迅速爬坡的过程,”宋高广博士表示,“但从 21 年起,资金迅速回落。有数据显示,2024年的医药投资额与2014年相似。这意味着医药投资回到了10年前的水平。但是中国医药企业的数量已经十倍于2014年的水平还不止,形成了狼多肉少的局面。”
“许多处于资金极度饥渴状态的创新药企业不得不通过BD、New-co、信贷等方式筹措更多资金。”洪镭博士补充道。
市场化资金减少注入的同时,CVC能否接棒成为支撑创新药企业发展的主力资金?
国际产业资本进入其实是种更加健康的变化。李寅博士表示:无论哪种投资人,去长期陪伴创新药企业成长都是个艰难的选择。因为创新药企业研发周期太长,归零的风险也非常高,所以恰当的时候如果有国内外的产业资本来接棒也是一种机会。他们不但有资金的支持,也有产业上的资源去更好的往前推进新药的研发。
另一方面,资本市场的遇冷,综合估值压低,也给投资人很多谈判的空间和筹码,邵辉博士表示:有很多创新药领域的投资机会,比如新技术CGT,新型抗体技术如三抗,针对难成药靶点的小分子领域都有不错的标的企业。
出海
叠加了上述所有创新药企们面临的现状之后,创新药企们开始把视野转到海外。
关于出海,有两个必须知道的事实:首先,美国医药市场是全球最大的医药市场,占据全球医药市场的1/3以上;其次,大部分国际大药厂们都正在经历众多专利面临过期的阶段。
“不光是规模最大。”邵辉博士补充道:“而且美国的药品定价全球最高,更是远高于中国。得美国市场者得天下,这是医药行业的普遍认知。”
另一方面,陈侃博士给我们解释道:“当下,国际大药厂所面临的LOE(Loss of Exclusivity),即众多专利面临过期的阶段,中间将会产生上千亿美元甚至更多的gap。想要填补就需要引进大量的产品,这是中国药企的绝佳机会。”
“以往,人们倾向于认为,国内开发的新药在国际上没有竞争力,只能在国内竞争。但2023年、2024年出现了一批重磅的BD和跨国并购案,都正慢慢改变着所有人的观点。”陈侃博士表示:“在投资逻辑层面,大家明显都更加关注产品的国际竞争力。”
创新药企们在出海模式的选择上,也不断地做出调整。传统的自主出海模式,由于国内药企的海外临床和商业化能力欠缺,导致能够实现自主出海的药物屈指可数。截至2024年7月,只有8款药物通过自主出海模式实现海外上市。
相比之下,2023年通过License-out实现出海的药物数量达到58笔,贸易金额超456亿美元,且2024年仍保持良好增长态势。“此外,New-co交易最近也开始加码。New-co交易指将公司核心产品的海外权利授权给海外成立的新公司,同时引入海外基金,搭建国际化管理团队,以公司海外上市或被并购实现退出。”洪镭博士补充道。
“越来越多的国内药企会掌握在海外进行产品开发的能力,会融入海外的资本市场,出海的方式也会多元化,不单只是把产品交易出去,而是会通过并购、共同开发、海外上市等方式实现出海。另外会涌现一批单个产品能够有30-50亿美元销售的预期,市值能够达到50亿-100亿美元的来自中国的全球化药企,这些都是潜在投资机会所在。”陈侃博士坚定地对我们表示。
国内创新药企们蓬勃的出海大潮下有什么隐藏的不足和风险?
“创新药的产品开发与其他行业不同,主要是临床试验开发,涉及到很多临床操作,所以企业出海的第一个问题就是中国企业在海外的临床试验能力严重不足;其次,中国创始人、管理团队在面对欧美投资人时,交流能力、沟通能力都相对偏弱;第三,对欧美企业来说,我们的数据呈现形式存在不足,在很多地方不一定能达到他们的要求;最后,我们常用的估值体系也和欧美不太一样,需要很高的沟通成本。”陈侃博士还表示:“而以上这些挑战,在今年来流行的New-co出海模式种,都得到了很好的解决。通过New-co,可以进行估值调整,管线拆分,引进美国的管理层,更好地实现资产的价值。”
不过New-co这种模式,也有自己的问题。“我们也看到一些隐忧。”洪镭博士分析道:
(1)New-co 模式的交易条款和谈判更为复杂,除去对首付款、里程碑+销售分成的考量,还需要考虑新公司股权、投票权、专利转移和税务等相关问题,这对团队的能力和协调性提出了更高的要求;
(2)在New-co模式下,M&A/IPO退出后有相当一部分资金会流到海外市场,只有少部分资金会回流至国内反哺产业链,这对国内产业链相对不利;
(3)在目前我们参与的New-co项目中,海外基金相对强势,企业由于选择有限常常处于劣势,在争取现金、谈判条款等方面都不尽如人意。
李寅博士还提到一个容易被人忽视的问题:“国内创新药企在出海时可能会面临的问题是资产价格被低估,定价权掌握在别人手里。不过,由于“工程师红利”和产业配套成熟带来的低成本,也确实是MNC找我们采买产品的原因之一。”
另一个比较现实的问题就是,从投资人的角度,如果国内创新药企的出海以资本交易形式,那么当初在投资条款中并没有设计与之匹配的退出模式。
张元博士解释称:“与国外Bio-tech公司的并购形式不同,中国的创新药公司在海外收并购形式上通常只是产品本身的授权,这就意味着投资人在退出时并没有设置相对应的退出机制。”
事实情况也确实如此,钛媒体创投家了解到,多家Bio-tech企业通过出海,取得了不错的销售收入,但是投资人却无法拿到回报,双方也正就这一矛盾积极寻求解决方案。
AI
今年最热的AI+生物医药的新闻莫过于诺奖的颁布。2024年10月9日下午,诺贝尔基金会宣布将今年的诺贝尔化学奖授予三位研究领域与AI相关的科学家,三位科学家的研究成果都和AI预测蛋白质结构有关,他们开发的AI解决方案成功应对了50年来蛋白质结构预测领域的重大挑战,加速了生物医药领域的科学发现。
“过去五十年内,科学家们只解析了2万个蛋白结构,而在‘阿尔法折叠2’问世后的短短几年内,这个数量上升到2亿个。”宋高广博士解释道:“这将极大推动生物医药领域的研究进度,就像百年前“构效理论”的提出一样,这套蛋白质结构的预测方法也为未来具体的药物开发提供了一个理论基础。基础科研的突破是对整个行业的极大促进,但在后端的实际应用和商业化方面仍然面临着很大的挑战,路还很长。”
虽然短期内不会有实际应用方面的商业化成果,“但是投资和市场关注度也会随着诺奖的颁布大幅提升,推动资金的涌入和更广泛的应用,推动企业在研发领域的投入和应用。”邵辉博士认为。
事实上AI制药领域的融资事件并不算少,数据显示,2024上半年,全球AI制药融资69起,投资额33.36亿美元,是2023年同期的两倍多。
在中国,AI制药融资同样吸睛。据不完全统计,2024上半年有18家AI制药获得投资,普遍投早投小,AI+蛋白质优化成为热点,拿下1亿美元融资的剂泰医药脱颖而出。
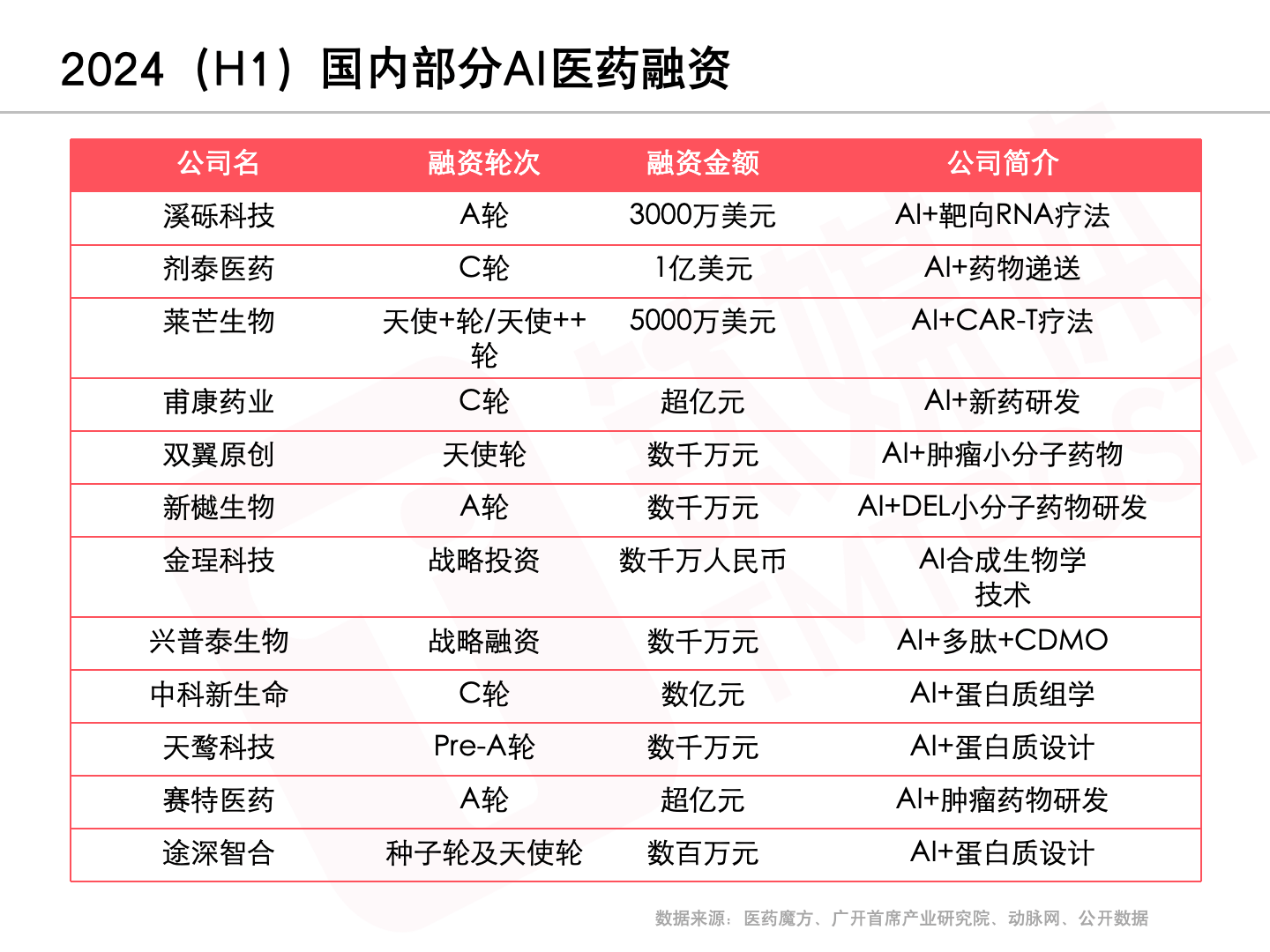
“因为很多制药公司都会用到一些AI的CADD或者更高级的工具,而在融资的时候也会愿意讲一些比较fancy的概念,但客观上我们知道他们都不是做AI制药的。”张元博士表示。“有时候,有前景和有投资机会是两件事。”
真正的AI制药为什么支撑不起一家创新药公司的核心价值?









 京公网安备 11011402013531号
京公网安备 11011402013531号